Traitements Adjuvants et/ou Palliatifs
Traitements > Traitements Adjuvants et/ou Palliatifs
Traitements Adjuvants et/ou Palliatifs
Les traitements ci-après sont utilisés soit pour potentialiser des stratégies thérapeutiques curatives le plus souvent combinés avec de la radiothérapie dans le cadre d’un traitement multimodal soit plus fréquemment comme option palliative à des stades plus tardifs. Contrairement à l’hormonothérapie et à la mitoxantrone, les autres stratégies sont toutes basées sur la médecine par la preuve concernant leur impact sur la survie (image 72). Ces traitements dits systémiques diffèrent des traitements localisés car ils agissent et diffusent à travers tout le corps tandis que les traitements curatifs ou “localisé à visée palliative” ont une action physique (ablation chirurgicale, irradiation ou laser) sur une cible précise.
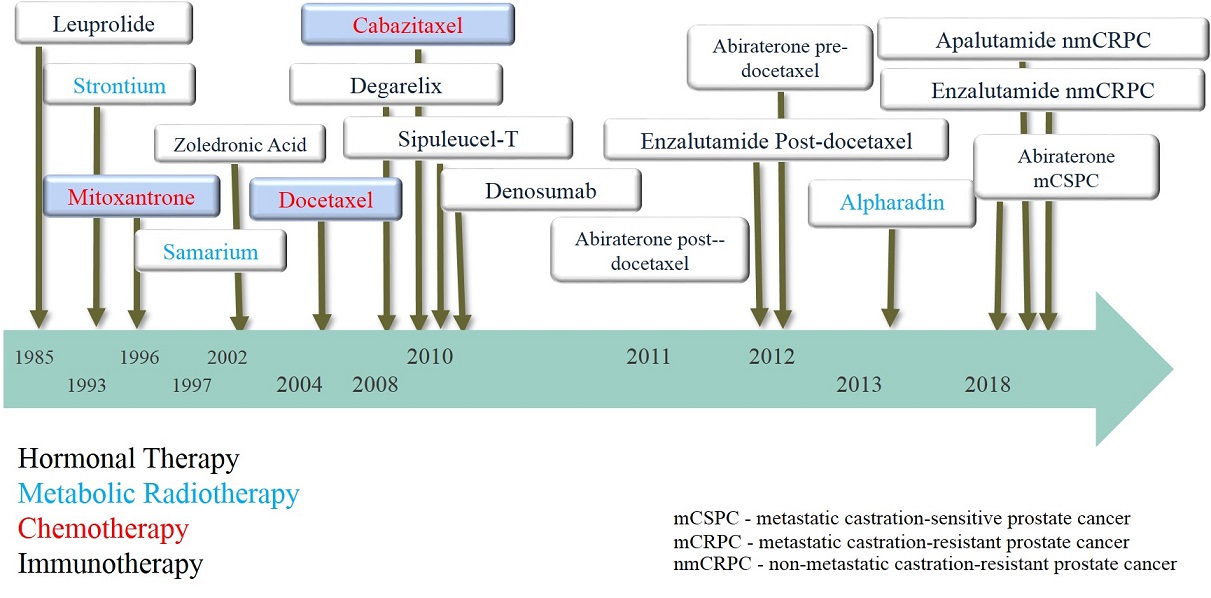
Image 72 : Principales étapes des traitements systémiques dans les cancers de la prostate avancées
Hormonothérapie
La suppression androgénique (ADT) est le traitement systémique le plus ancien dans le cancer de la prostate. Il a été publié par C. Huggins en 1941 ce qui lui a valu le prix Nobel de Médecine en 1966 (image 73). Le rationnel de ce traitement provient de la dépendance du cancer de la prostate aux androgènes qui sont un véritable carburant nécessaire à la croissance et à la progression des cellules cancéreuses. Chez l’homme, les androgènes sont produits à 95% par les testicules et à 5% par les glandes surrénales. La production de testostérone dépend de l’axe hypotalamo-hypophysaire. L’hypothalamus produit la lutéinostimuline (LH-RH) qui déclenche la production de l’hormone lutéinisante (LH) par l’hypophyse. LH stimule, à son tour, la production des androgènes par les cellules de Leydig au sein des testicules (image 74). L’hypothalamus contrôle l’hypohyse par des sécrétions intermittentes de lutéinostimuline.
Pendant longtemps, la suppression androgénique était obtenue par ablation chirurgicale des testicules (orchidectomie). Dans les années 80, les premiers agonistes LH-RH (p.e leuproréline, goséréline or triptoréline) ont permis une castration chimique. L’effet thérapeutique des injections intra-musculaires durait initialement 1 mois pour passer ultérieurement à 3 mois et, au début des années 2000, à 6 mois. Il peut sembler contradictoire d’injecter un agoniste LH-RH qui, naturellement, stimule la production d’androgènes par le testicule, dans le but d’obtenir, une suppression androgénique. Cependant, l’astuce biologique provient de la différence entre le rythme naturellement intermittent des sécrétions de LH-RH par l’hypothalamus et l’afflux continue de LH-RH lié à l’injection de l’agoniste. Le disponibilité continue de LH-RH provoque un blocage de la sécrétion de LH et de la fabrication des androgènes d’origine testiculaire. En plus des habituels effets secondaires tels que bouffées de chaleurs, impact majeur sur les fonctions sexuelles, perte musculaire et fatigue, un des principaux inconvénients des agonistes LH-RH est l’effet dit flair-up. En effet, pendant les 2-3 premières semaines suivant la première injection, l’effet agoniste va jouer et la production de testostérone va croître entraînant par la même une progression de la maladie. Habituellement pour éviter cette phase initiale de flair-up, il convient d’adjoindre un traitement hormonal complémentaire par anti-androgènes (p.e. bicalutamide ou flutamide) pendant 2 à 3 semaines.

Image 73 : Publication princeps de C. Huggins et C.V. Hodges dans Cancer Research en 1941
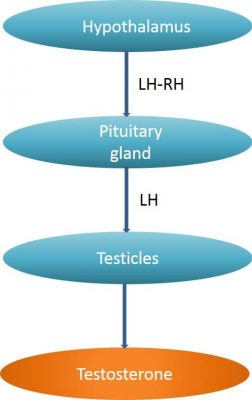
Image 74 : Place de l’axe hypothalamo-hypophysaire dans la sécrétion de la testostérone
Une autre façon d’éviter l’effet flair-up est d’utiliser un antagoniste LH-RH en lieu et place d’un agoniste. Cependant, il a fallu attendre 2008 pour que le premier antagoniste (degarelix) soit approuvé. Pour des raisons de galénique, les antagonistes nécessitent une injection mensuelle.
L’hormonothérapie est principalement utilisée en première ligne des traitements palliatifs afin de ralentir la progression, avec généralement un bon impact thérapeutique sur la présence de métastases. Le plus souvent, initialement, le cancer de la prostate tend à être hormono-sensible (CPHS) ce qui signifie qu’à ce stade, il répond à la suppression androgénique. Après un temps, variable, le cancer de la prostate devient hormono-résistant (CPHR). A ce stade plus avancé, l’hormonothérapie est moins ou non efficace et d’autres traitements systémiques sont nécessaires pour prévenir la progression du cancer. Lorsque le cancer devient hormonorésistant, malgré des preuves scientifiques limitées, la suppression androgénique est maintenue. Plus récemment, l’hormonothérapie a été associée à la radiothérapie externe dans le cadre d’un traitement multimodal appelé le protocole Bolla. Cette stratégie multimodale est fondée sur la synergie entre l’effet biologique de la suppression androgénique et l’effet physique des radiations sur les cellules cancéreuses prostatiques (voir Traitements Validés – Radiothérapie Externe).
La dernière innovation dans le champ de l’hormonothérapie du cancer de la prostate est la perspective d’un antagoniste LH-RH oral nommé relugolix qui présente l’avantage d’un arrêt rapide en cas de nécessité.
Chimiothérapie
Excluant la mitoxantrone qui n’a pas d’impact sur la survie des patients en cas de cancer avancé, ce n’est pas avant 2004 que la chimiothérapie est devenue un traitement validé pour le cancer de la prostate. Jusque-là, les oncologues n’étaient pas impliqués dans le cancer de la prostate. Les urologues avaient alors l’habitude de s’occuper de leurs patients des stades les plus précoces du cancer aux maladies métastatiques les plus avancées. La première utilisation de la chimiothérapie dans le cancer de la prostate concernait des patients CPHR. Dans le cas du cancer de la prostate, la chimiothérapie est toujours administrée par voie intra-veineuse et, le plus souvent, nécessite la mise en place d’un cathéter à chambre implantable (port-a-cath) qui correspond à un petit dispositif médical placé sous la peau au niveau thoracique droit (image 75).
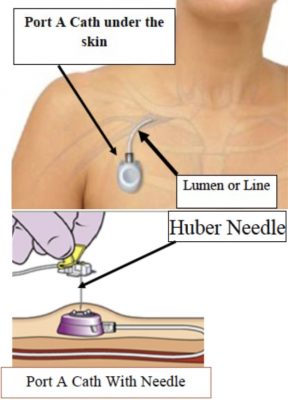
Image 75 : Cathéter à chambre implantable placée au niveau de l’hémi-thorax droit
La première chimiothérapie validée dans le cancer de la prostate métastatique a été le docetaxel qui a montré dans l’étude TAX327 une modeste augmentation de la survie globale de 2.5 mois [37]. En 2010, le cabazitaxel, qui fait aussi partie de la famille des taxanes, a été approuvé à son tour, également avec une courte augmentation de la survie de 2.4 mois [38]. Dans un second temps, le docetaxel a été évalué pour des patients CPHS, montrant cette fois une meilleure amélioration de la survie atteignant presque 14 mois lorsque comparé au sevrage androgénique seul. Pour les cancers de hauts volumes métastatiques, l’amélioration de la survie était encore accrue au-delà de 17 mois [39].
Le docetaxel tout comme le cabazitaxel sont tous deux utilisés en second ligne lorsque le cancer de la prostate devient hormono-résistant. Cependant, le docetaxel associé à l’hormonothérapie peut également être utilisé en premier ligne de cancer de la prostate hormono-sensible (CPHS).
Thérapies ciblées
Les thérapies ciblées correspondent à la dernière innovation thérapeutique dans le champ des cancers avancés de la prostate. Ils sont les résultats de décennies de recherche de biologie moléculaire et de découverte de cibles moléculaires intra-cellulaires pouvant être bloquées par des molécules thérapeutiques. Les thérapies ciblées sont administrées oralement.
- Les hormonothérapies de deuxième génération
Deux molécules représentent cette nouvelle génération d’hormonothérapie des cancers de la prostate à un stade avancé. L’acétate d’abiratérone et l’enzalutamide ont été approuvés respectivement en 2011 et 2013 (image 76-77). L’abiratérone exerce une forte action sur le récepteur aux androgènes (AR) tandis que l’enzalutamide inhibe CYP-17 qui est une enzyme nécessaire pour la synthèse des androgènes. Ces nouvelles thérapies à visée anti-androgénique sont indiquées dans les cancers métastatiques hormono-résistants (CPHR) en première ligne et également en seconde ligne après chimiothérapie [40-43]. Lorsqu’un de ces 2 traitements est inefficace, généralement l’autre l’est également.

Image 76 : Structure moléculaire de l’acétate d’abiratérone
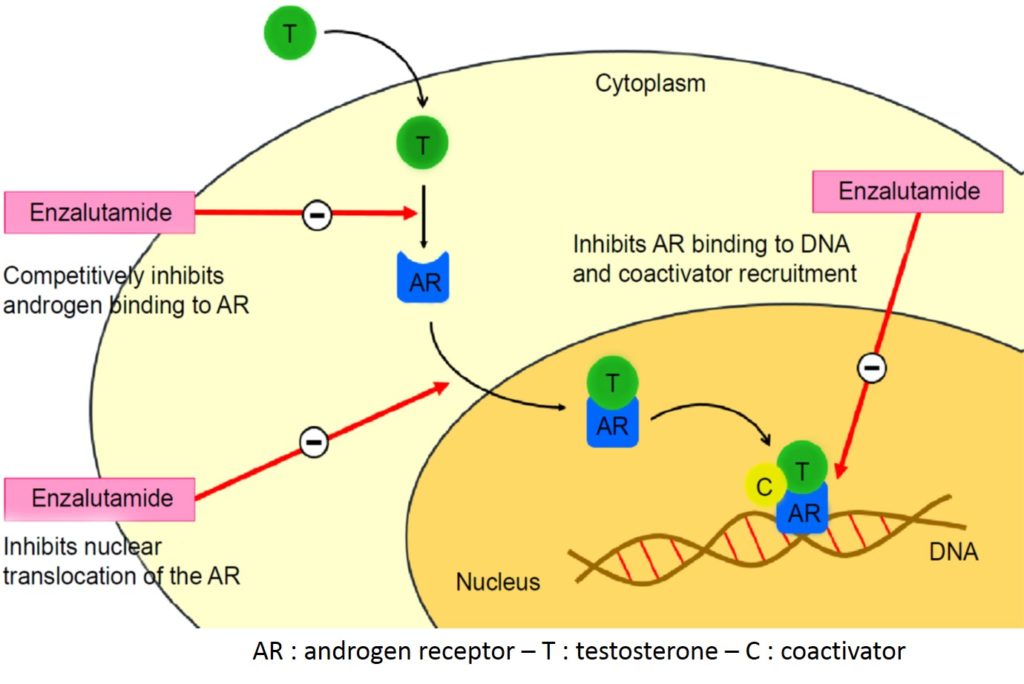
Image 77 : Mécanisme d’action de l’enzalutamide au niveau de la voie de signalisation du récepteur aux androgènes (source : Rodriguez-vida A. et al. Drug Design, Development and Therapy 2015)
- Les inhibiteurs de PARP
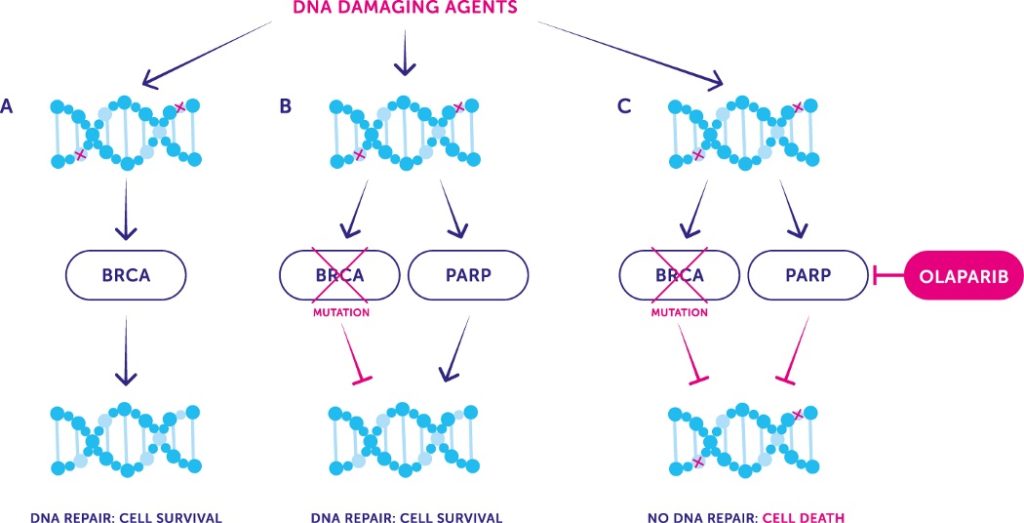
Image 78 : Bloquage du système SRM par les Inhibiteurs PARP entraînant la mort des cellules tumorales (source : Cancer UK)
Immunothérapie
L’immunothérapie est une approche thérapeutique oncologique visant à restaurer/renforcer le système immunitaire dans le but de détruire les cellules cancéreuses. Elle agit principalement via les lymphocytes T qui sont des cellules immunitaires spécialisées dans la destruction des cellules cancéreuses.
- Pembrolizumab
Pembrolizumab est un anticorps monoclonal qui cible également le système SMR tout comme l’olaparib mais de façon différente. En effet, les cellules cancéreuses ont la capacité de produire des ligands (PD-L1 [program death ligand 1] et PD-L2) qui se lient à des récepteurs des cellules immunitaires T en vue de les rendre inactives. En se liant aux récepteurs, PD-L1 et PD-L2 bloquent la réponse immunitaire des lymphocytes T qui sont normalement programmées pour détruire les cellules cancéreuses (image 79). Pembrolizumab entre en compétition avec PD-L1 et PD-L2 en se fixant avec une plus grande affinité sur le récepteur PD1 mais sans pour autant bloquer le fonctionnement cellulaire. Ainsi, pembrolizumab permet de restaurer la réponse immunitaire des lymphocytes T (image 80). Pembrolizumab a été approuvé pour les patients CPHR métastatiques ayant des mutations au niveau des gènes impliqués dans le système SMR.

Image 79 : Inactivation des lymphocytes T par les ligands PD-L1 et PD-L2 se liant au récepteur PD-1 (source : www.keytrudahcp.com)
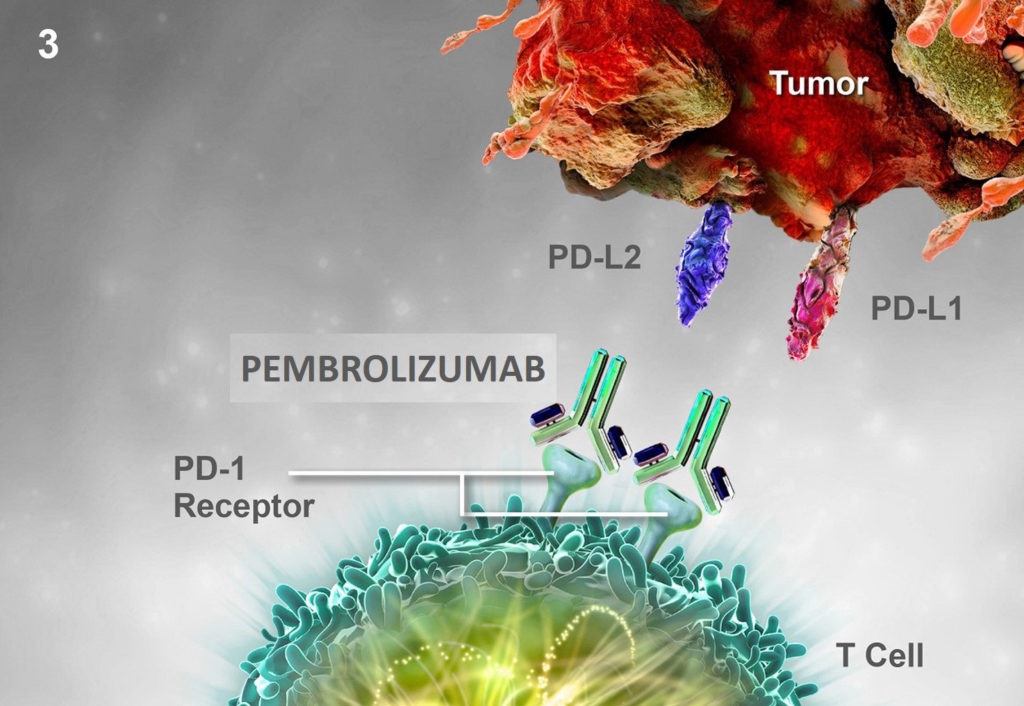
Image 80 : Liaison compétitive du pembrolizumab au récepteur PD-1 bloquant les interactions avec PD-L1 et PD-L2 et réactivant la réponse immunitaire des lymphocytes T (source : www.keytrudahcp.com)
- Sipuleucel-T
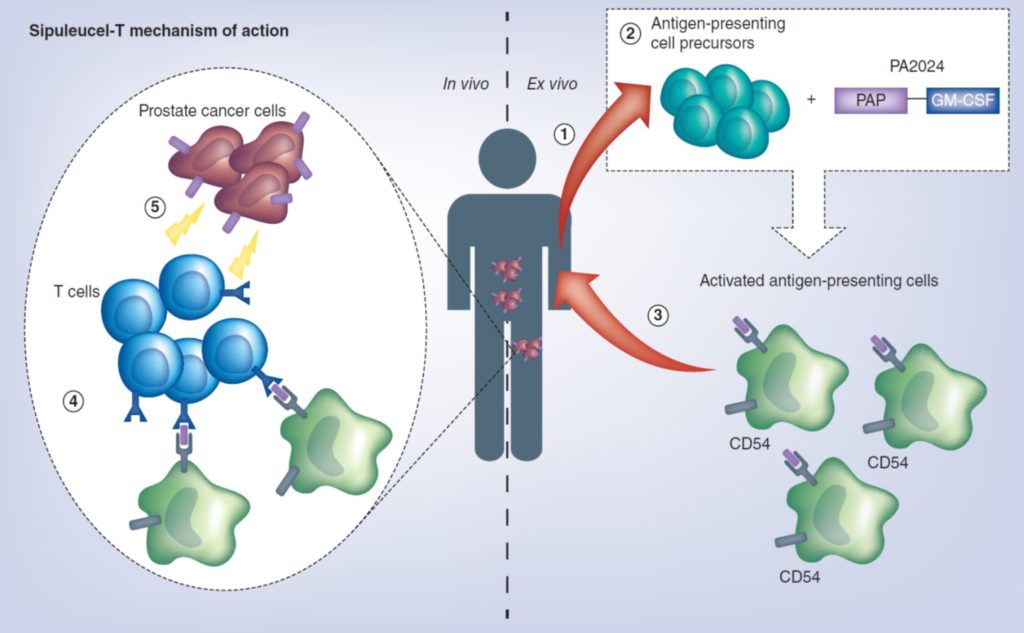
Image 81 : Mécanisme d’action du Sipuleucel-T (source : Handy CE and Antonarakis ES. Future Oncol. 2018)


